Molécula es un grupo de átomos iguales o desiguales sin carga neta, combinados en proporciones definidas, unidos mediante enlace químico y actuando físicamente y químicamente como una unidad simple.
Una molécula es la menor porción de una sustancia compuesta capaz de existir en condición libre, y que conserva todas las propiedades de dicha sustancia compuesta, es decir, la partícula más pequeña de una sustancia compuesta que puede existir sin descomponerse en sus átomos constituyentes.No todas las sustancias compuestas ocurren en forma molecular. Por ejemplo, el NaCl (cloruro de sodio) no es una molécula. El NaCl esta formado por iones Na+ e iones Cl-que forman un cristal. En este tipo de compuesto, los iones con signos opuestos se unen mediante fuerzas electrostáticas o enlace químico electrovalante.
Las moléculas se unen mediante interacciones de Van der Waals que pueden ser: interacción dipolo-dipolo entre moléculas polares, interacción dipolo-dipolo inducido e interacción dipolo inducido-dipolo inducido o interacción por dispersión (fuerzas de dispersión de London). El enlace mediante puente de hidrógeno es un tipo de interacción dipolo-dipolo. La interacción dipolo inducido-dipolo inducido ocurre en moléculas no polares.
La gran mayoría de las sustancias volátiles son moléculas.
Si la molécula está formada por átomos iguales (misma naturaleza) se denomina homoatómica, homonuclear u homogénea. Si está formada por átomos diferentes (diferente naturaleza) es heteroatómica, heteronuclear o heterogénea.
La fórmula molecular determina el número y clase de átomos que forman una molécula. Por ejemplo, CO2 indica que una molécula de dióxido de carbono está formada por un átomo de carbono por cada dos átomos de oxígeno. Moléculas polares como, por ejemplo, el agua posee interacciones mediante puente de hidrógeno, las moléculas de agua se asocian haciendo que el agua tenga la fórmula (H2O)n (n es el número de moléculas asociadas). Moléculas que se asocian presentan una masa molar aparente superior a su masa molar real. Por ejemplo, el ácido acético(CH3COOH) en fase de vapor a 124,8°C posee una masa molecular relativa aparente de 90,35 (determinada mediante el método de Dumas), mientras que su masa molecular relativa real, determinada mediante las masas atómicas de sus elementos constituyente, es de 60,05. La diferencia entre las masas moleculares relativas se debe al grado de asociación entre las moléculas del ácido acético.
La siguiente figura muestra ejemplos de moléculas.
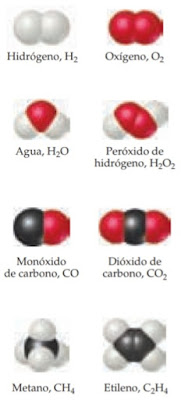 |
| Ejemplos de moléculas |
Las masas moleculares relativas se determinan mediante un espectrometro de masas, pero también se pueden utilizar métodos basado en la ley de los gases y propiedades coligativas de las soluciones, entre otros métodos.
La masa de una molécula (denominada a veces masa molecular absoluta) se determina multiplicando la masa molecular relativa por el valor de la unidad de masa atómica unificada (u o Da).
masa de la molécula = Mr 1,66053906660(50)x10-27 kg.
El tamaño de una molécula está en los alrededores de 2x10-10m o 200 pm.
 |
| Amadeo Avogadro |
existen el mismo número de moléculas. En la actualidad, la hipótesis de Avogadro se considera una ley. El número de entidades contenidas en un mol se denomina constante de Avogadro en honor honor a Amadeo Avogadro.
NA= 6,02214076x1023 mol-1


















































